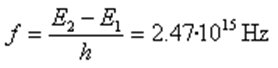MODELOS ATÓMICOS
MODELO ATÓMICO DE BOHR
Un átomo tiene una dimensión del orden de 10-9 m. Está compuesto por un núcleo relativamente pesado (cuyas dimensiones son del orden de 10-14 m) alrededor del cual se mueven los electrones, cada uno de carga (–e) (e = 1,6 10-19 C), y de masa me (me = 9,1·10-31 kg).
El núcleo está compuesto por protones y neutrones. El número Z de protones coincide con el número de electrones en un átomo neutro. La masa de un protón o de un neutrón es aproximadamente 1850 veces la de un electrón. En consecuencia, la masa de un átomo es prácticamente igual a la del núcleo.
Sin embargo, los electrones de un átomo son los responsables de la mayoría de las propiedades atómicas que se reflejan en las propiedades macroscópicas de la materia.
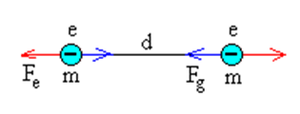
Consideremos dos electrones separados una distancia d, y comparemos la fuerza de repulsión eléctrica con fuerza de atracción entre sus masas.
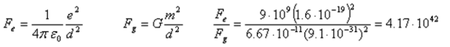
|
La intensidad de la interacción gravitatoria es despreciable frente a la interacción electromagnética. |
|
El modelo de Bohr es muy simple y recuerda al modelo planetario de Copérnico, los planetas describiendo órbitas circulares alrededor del Sol. El electrón de un átomo o ión hidrogenoide describe también órbitas circulares, pero los radios de estas órbitas no pueden tener cualquier valor. Consideremos un átomo o ión con un solo electrón. El núcleo de carga Ze es suficientemente pesado para considerarlo inmóvil, |
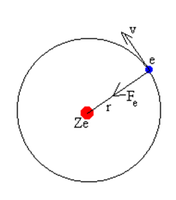
Si el electrón describe una órbita circular de radio r, por la dinámica del movimiento circular uniforme
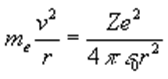
En el modelo de Bohr, solamente están permitidas aquellas órbitas cuyo momento angular está cuantizado.
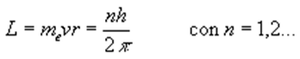
|
n es un número entero que se denomina número cuántico, y h es la constante de Planck 6,6256·10-34Js |
|
Los radios de las órbitas permitidas son: |

|
Donde a0 se denomina radio de Bohr. Entonces, a0 es el radio de la órbita del electrón del átomo de Hidrógeno Z=1 en su estado fundamental n=1. |
|
La energía total es: |
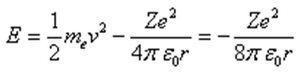
En una órbita circular, la energía total E es la mitad de la energía potencial:
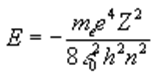
La energía del electrón aumenta con el número cuántico n.
La primera energía de excitación es la que lleva a un átomo de su estado fundamental a su primer (o más bajo) estado excitado. La energía del estado fundamental se obtiene con n=1, E1 = -13,6 eV y la del primer estado excitado con n=2, E2 = -3,4 eV. Las energías se suelen expresar en electrón-voltios (1eV=1,6 10-19 J)
La frecuencia f de la radiación emitida cuando el electrón pasa del estado excitado E2 al fundamental E1 es :